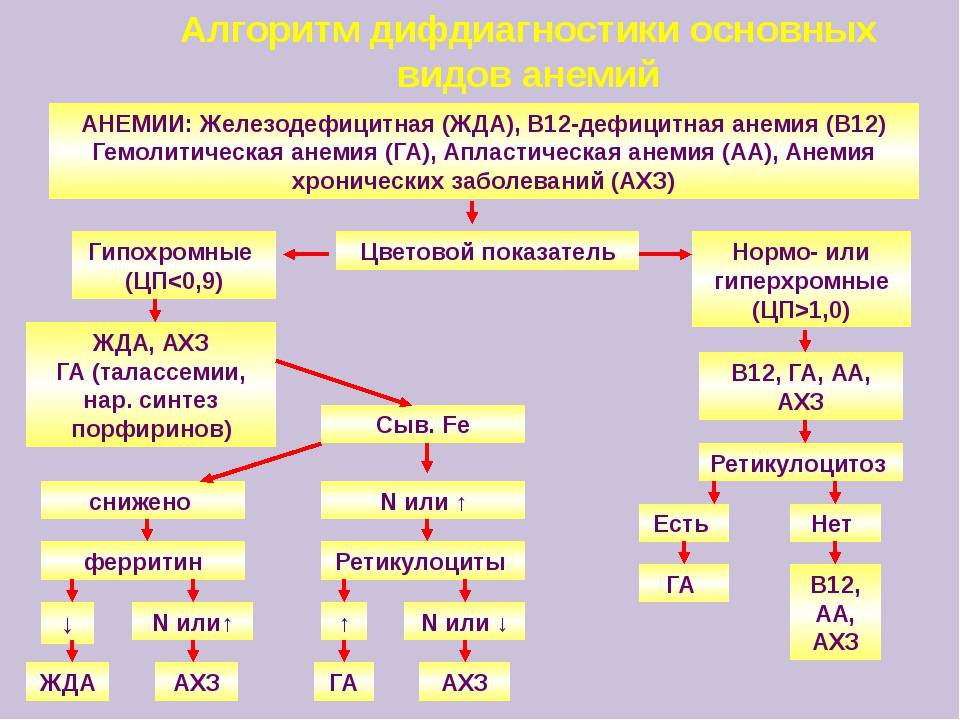
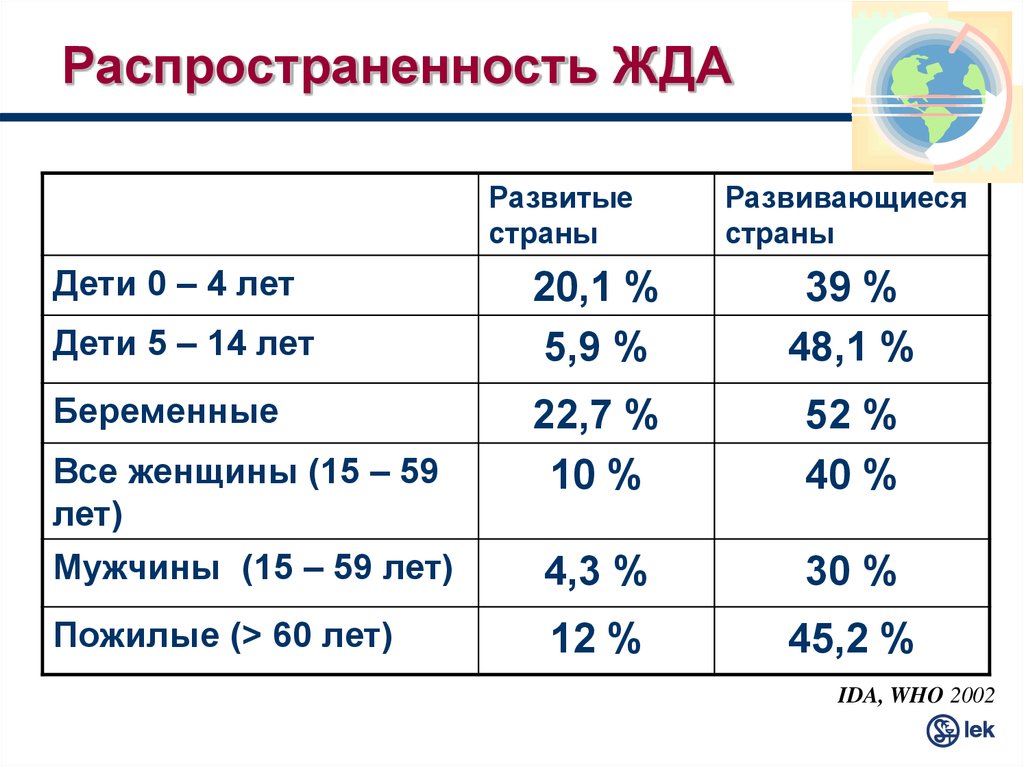
Клиническая картина
Течение заболевания хроническое рецидивирующее. Характерны бледность кожи и слизистых оболочек, одутловатость лица, слабость, физическую утомляемость и психическая вялость, одышка при движениях, частые головокружения, шум в ушах.
Хроническая кислородная недостаточность тканей в связи с анемией ведет к нарушению функционального состояния печени, сердечной мышцы и других органов. При объективном обследовании отмечаются тахикардия, анемические сердечные шумы (систолический шум на верхушке, обусловленный снижением вязкости крови), шум волчка на яремных венах, повышение скорости кровотока. На ЭКГ признаки диффузной гипоксии миокарда, при поликардиографии (см.) — снижение сократительной функции миокарда при длительно существующей анемии. Дефицит железа проявляется извращением вкуса (pica chlorotica) — пристрастие к мелу в различных видах, иногда углю, известке, сухой крупе; больному нравятся запахи керосина, бензина, выхлопных газов; характерны трофические изменения ногтей — появляется продольная или поперечная исчерченность, иногда ногти становятся ложкообразными (койлонихия); развивается сидеропеническая дисфагия (симптом Россолимо—Бехтерева или Пламмера — Винсона). При эзофагоскопии и рентгенол, исследовании видны атрофические изменения слизистой оболочки глотки и пищевода и спастическое сужение его начальной части. Перечисленные симптомы нередко обнаруживаются уже в стадии латентного гипосидероза и предшествуют развитию анемии.
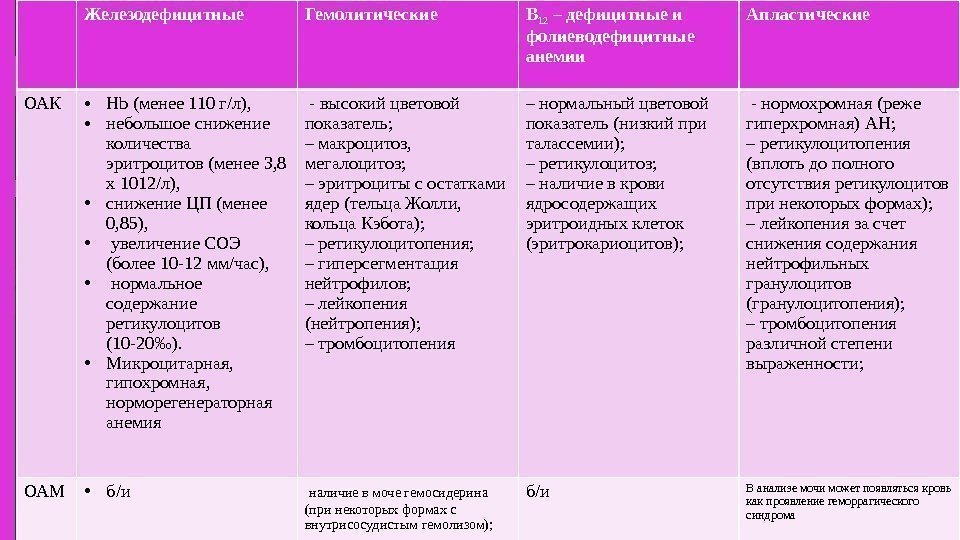
Картина крови характеризуется гипохромной анемией — снижением концентрации гемоглобина и низким цветным показателем (0,6—0,5 и ниже). Число эритроцитов может быть нормальным, но обычно также снижается, хотя и в меньшей степени, чем гемоглобин. Морфологически отмечается гипохромия эритроцитов, их макроцитоз, анизопойкилоцитоз (см. Гемограмма). При наличии макроцитоза с гипохромией эритроцитов можно предполагать сочетание дефицита железа и B12-витаминной недостаточности.
Этиология и патогенез
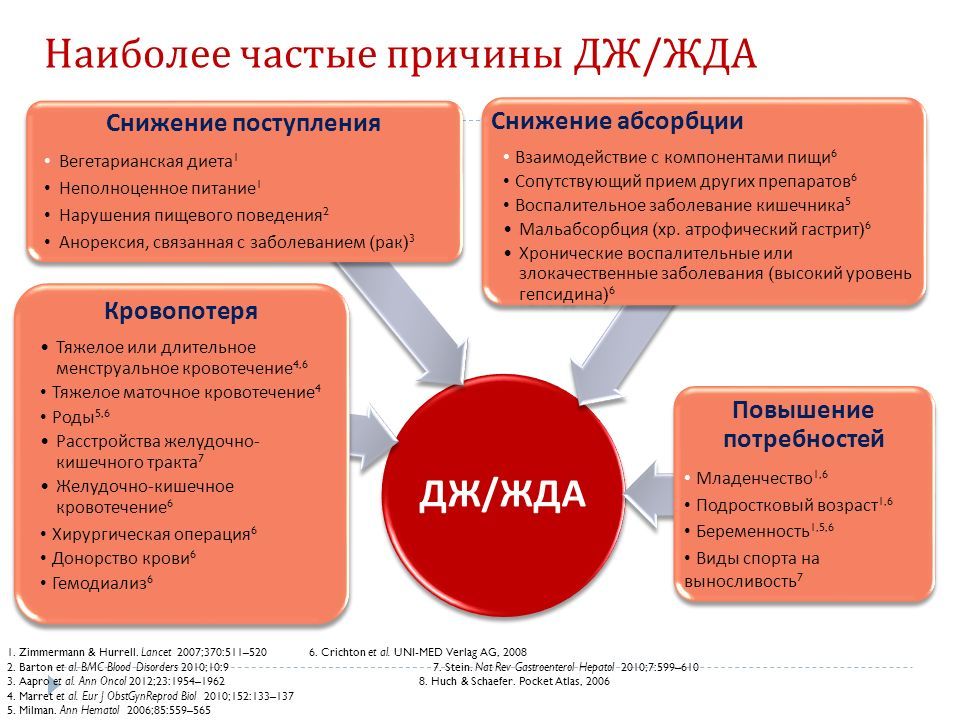
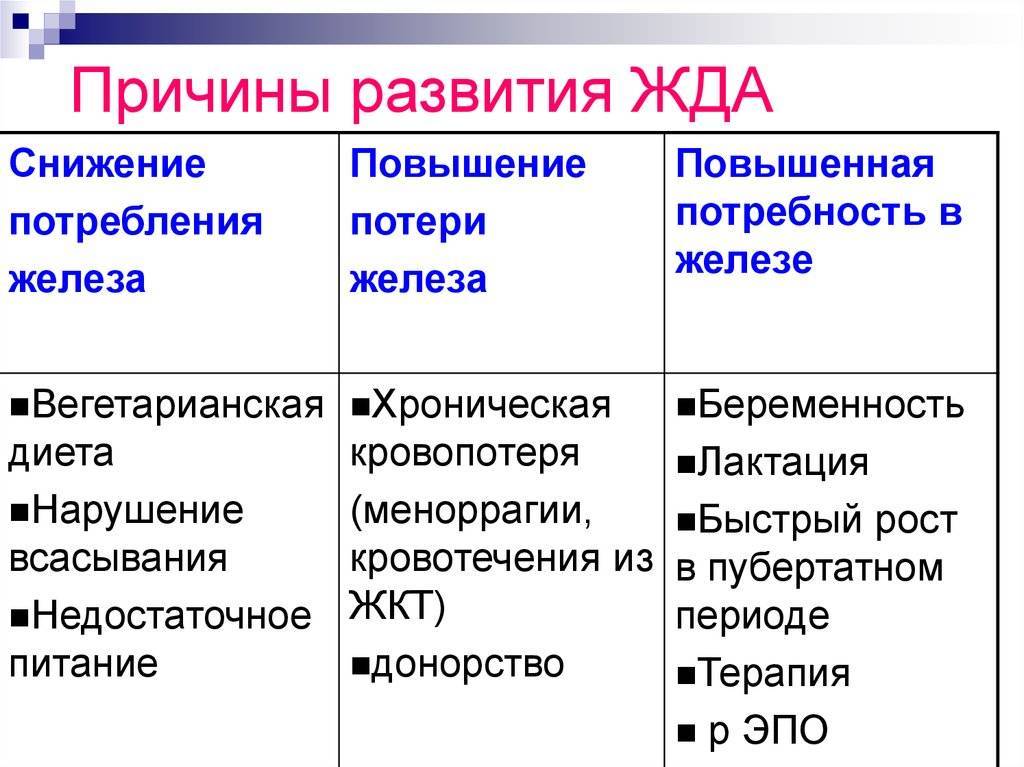
Железодефицитные анемии могут быть обусловлены рядом причин. Повторные кровопотери, даже необильные и скрытые, ведут к потере железа, истощению его резервов в организме и развитию латентного дефицита железа, а затем хронической постгеморрагической Железодефицитной анемии. Причиной кровопотерь часто являются маточные кровотечения, реже жел.-киш., почечные, легочные и др.
Железодефицитная анемия может развиваться под влиянием экзогенных факторов. Так, анемия, связанная с недостатком железа в пище, отмечается у детей, находящихся на однообразном молочном питании, особенно при искусственном вскармливании коровьим или козьим молоком. Для развития Ж. а. у новорожденных может иметь значение дефицит железа у матери во время беременности. В СССР и других экономически развитых странах алиментарная Ж. а. у взрослых встречается редко — при длительной однообразной, преимущественно молочной диете. В развивающихся странах среди необеспеченных слоев населения алиментарная недостаточность может быть причиной анемий гораздо чаще. Другие экзогенные факторы (инфекции, интоксикации, глистные инвазии) влияют на эндогенные механизмы обмена и утилизации железа, что приводит к его перераспределению и развитию относительного дефицита.
Эндогенная недостаточность железа может быть следствием повышенного расхода железа в периоды роста и созревания организма, а также беременности, лактации. Причиной Ж. а. у девушек в пубертатном периоде (ранний, или ювенильный, хлороз) может явиться повышение потребности организма в железе в связи с ростом, появлением менструальных кровотечений, угнетающим действием эстрогенных гормонов на синтез гема. Ж. а. у взрослых женщин обычно связана с маточными кровотечениями (дисфункциональными или на почве фибромиомы матки). Нарушение абсорбции железа и других веществ, важных для кроветворения, происходит также после резекции желудка или части тонкой кишки.
Железодефицитная анемия может быть обусловлена как каждым из перечисленных факторов в отдельности, так и одновременным сочетанием всех или ряда из них. Возможно развитие Ж. а. на фоне хрон, воспалительного процесса, бластоматозов (ранее они объединялись понятием «симптоматические хлоранемии»). В этих случаях, помимо дефицита железа, который носит перераспределительный характер, имеет место миелотоксическое действие основного процесса на гемопоэз.
Патогенез Ж. а. заключается в нарушении синтеза гема из-за недостатка железа в организме и развитии истинного дефицита железа (с истощением его резервов) или в нехватке железа для эритропоэза вследствие перераспределения.
Гейнрих (Н. С. Heinrich, 1970) различает следующие стадии развития дефицита железа: 1) прелатентный дефицит железа, определяемый гистохимически по отсутствию гемосидерина в макрофагах ретикулогистиоцитарной системы костного мозга, а косвенно — на основании повышенной кишечной абсорбции железа; 2) латентный дефицит железа, характеризующийся снижением концентрации сывороточного железа и повышением общей и особенно латентной железосвязывающей способности сыворотки (ОЖСС и ЛЖСС); 3) железодефицитная (гипосидеремическая) анемия с дальнейшим снижением содержания железа в организме и нарушением гемоглобинизации эритроцитов.
Современные представления о патогенезе дефицита железа и развитии Ж. а. опираются на исследования обмена железа в нормальных и патол, условиях. Потеря железа при повторных кровотечениях или недостаточность его всасывания в связи с уменьшением поступления с пищей, а также нарушением абсорбции ведет к уменьшению резервов железа, снижению сывороточного железа и повышению ОЖСС и особенно ЛЖСС с уменьшением процента насыщения переносчика железа— трансферрина (сидерофилина). В результате снижается транспорт железа в костный мозг и уменьшается его включение в клетки эритропоэтического ряда путем микропиноцитоза из ретикулярных клеток или прямой передачи от трансферрина через рецепторные участки ретикулоцитов. При этом снижается поступление в клетку железа, необходимого для синтеза гема.
Следствием нехватки железа для синтеза гема является увеличение протопорфирина в эритроцитах при некоторых формах Ж. а. В условиях дефицита железа резервы его мобилизуются для нужд эритропоэза, что ведет к уменьшению, в частности, костномозгового депо железа. Нарушение образования гема и гемоглобинизации эритробластов является конечной фазой недостаточности эритропоэза, вызванной истинным или перераспределительным дефицитом железа в организме.
Лечение
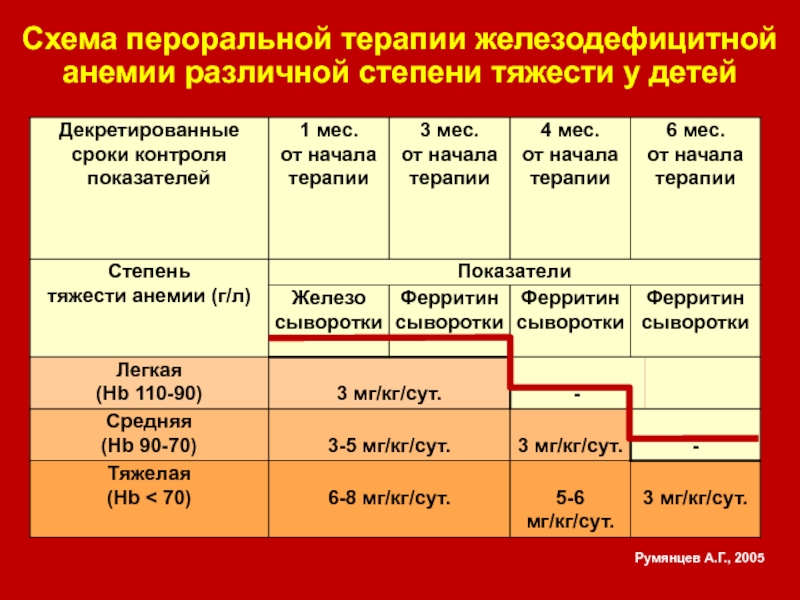
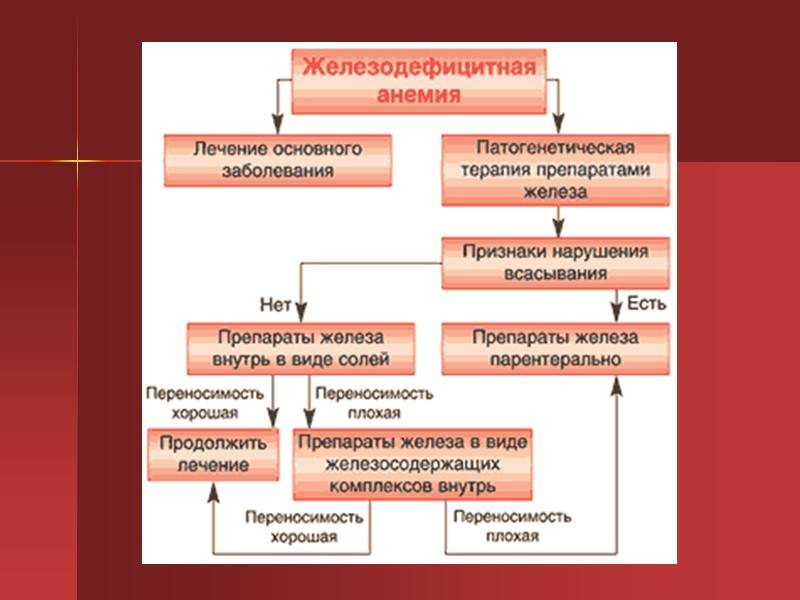
Лечение должно быть направлено на устранение причин анемии (прекращение и предупреждение кровопотере при необходимости — оперативное удаление их источника; лечение заболеваний желудка и кишечника и т. д.) и на ликвидацию дефицита железа (железо-терапия).
Для пероральной железотерапии применяется ряд препаратов. Наиболее эффективны и хорошо переносимы гемостимулин, ферроцерон и комплексные препараты сернокислого железа.
Аскорбиновая к-та, назначаемая одновременно с препаратами железа или входящая в их состав, обеспечивает лучшее усвоение железа. Полезны одновременные инъекции витамина B6 и прием фолиевой к-ты. Если наблюдается отставание роста числа эритроцитов, то может быть рекомендовано введение витамина В12 в конце курса железотерапии.
Парентеральная железотерапии показана при непереносимости приема препаратов железа внутрь, их неэффективности, агастрии, при противопоказаниях к пероральной терапии (язвенные и воспалительные процессы в жел.-киш. тракте), тяжелой анемии, требующей быстрого купирования (в предоперационном или предродовом периоде). Для внутримышечного введения рекомендуются фербитол или ектофер; для внутривенного введения — ферковен или феррум Лек. В ампулах этих препаратов содержится по 100 мг железа. Число инъекций рассчитывается по формуле, данной в специальной инструкции (обычно от 15 до 30 инъекций).
Критерием эффективности железотерапии является увеличение гемоглобина (на 0,15—0,3 г% в сутки. Продолжительность курса лечения зависит от нормализации сывороточного железа, а в клин, условиях исследуется депо железа по десфераловой пробе.
Гемотерапия при Ж. а. применяется при глубокой анемии и необходимости быстрого купирования анемической гипоксии, а также при гипорегенераторных формах, резистентных к железотерапии. Предпочтительны переливания эритроцитной массы по 125—150 мл 2 раза в неделю в количестве 3—4 трансфузий. Рекомендуется полноценное питание.